第三节化学键 (第一课时)
【课时目标】(1)对离子键和离子化合物概念的理解;(2)电子式的正确书写
【基础知识】
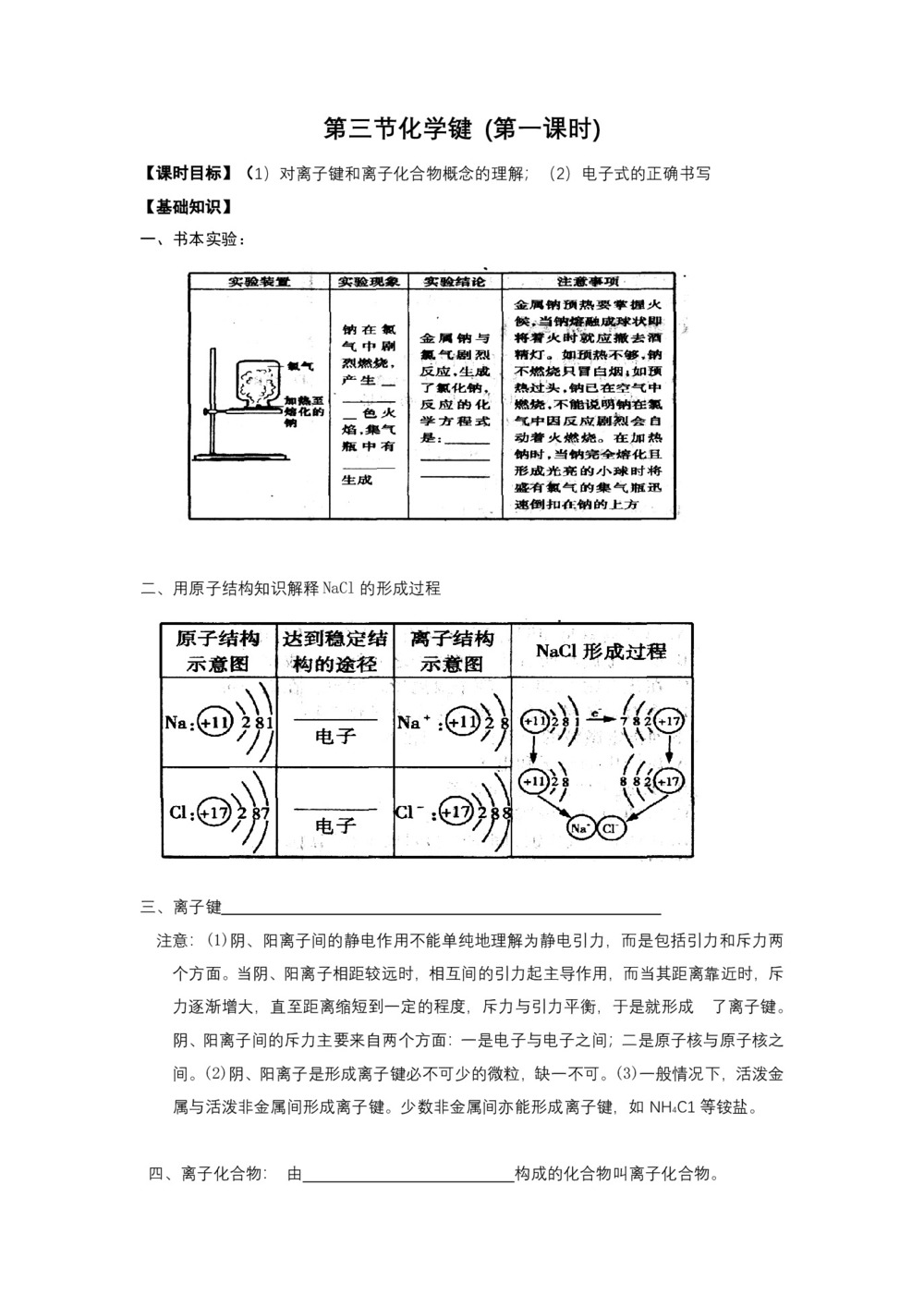
一、书本实验:
二、用原子结构知识解释NaCl的形成过程
三、离子键
注意:(1)阴、阳离子间的静电作用不能单纯地理解为静电引力,而是包括引力和斥力两个方面。当阴、阳离子相距较远时,相互间的引力起主导作用,而当其距离靠近时,斥力逐渐增大,直至距离缩短到一定的程度,斥力与引力平衡,于是就形成 了离子键。阴、阳离子间的斥力主要来自两个方面:一是电子与电子之间;二是原子核与原子核之间。(2)阴、阳离子是形成离子键必不可少的微粒,缺一不可。(3)一般情况下,活泼金属与活泼非金属间形成离子键。少数非金属间亦能形成离子键,如NH4C1等铵盐。
四、离子化合物: 由 构成的化合物叫离子化合物。
注意:(1)离子化合物中不一定含金属元素,如NH4NO3,是离子化合物,但全部由非金
-
相关教案下载
- 12018-2019学年人教版必修2 第一章第三节化学键(第一课时)——共价键 教案
- 22018-2019学年人教版必修2 第一章第三节 化学键第1课时 学案
- 32018-2019学年人教版必修2 第一章第三节 化学键第2课时 学案
- 42018-2019学年人教版必修2 第一章第三节化学键第2课时共价键 学案
- 52018-2019学年人教版必修2 第一章第三节化学键第1课时离子键 学案
- 62018-2019学年人教版必修2 第一章第三节化学键 教案
- 72018-2019学年人教版必修2 第一章第三节化学键第3课时分子间作用力和氢键 学案
- 82017-2018学年人教版必修二 第一章第三节 化学键 教案
- 92018-2019学年人教版必修二 第一章 第三节 第2课时 共价键 学案