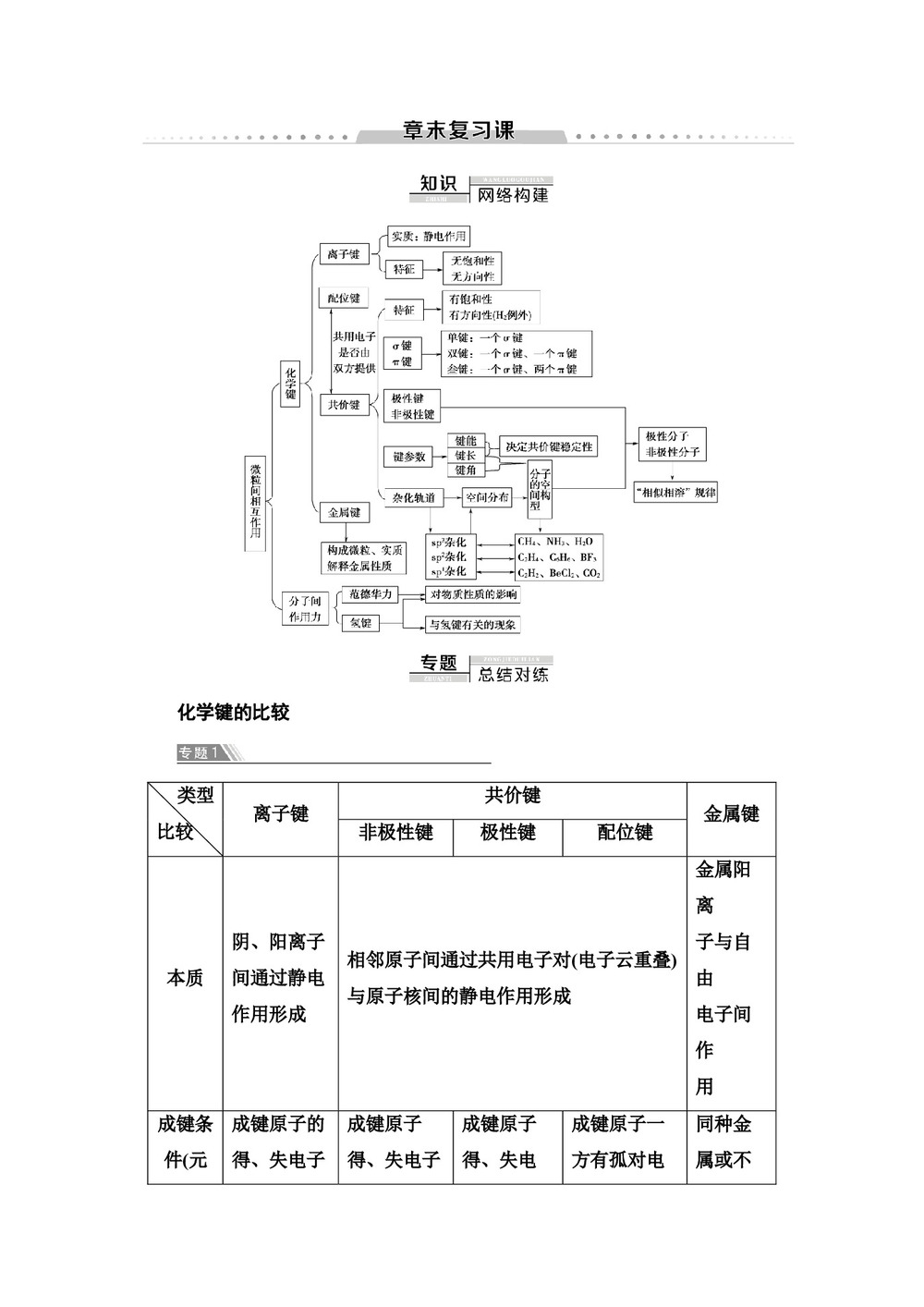
-
相关教案下载
- 12019-2020学年鲁科版选修3 第2章第4节 分子间作用力与物质性质 学案
- 22018-2019学年鲁科版选修3 第2章 第4节 分子间作用力与物质性质 学案
- 32018-2019学年鲁科版选修三 第2章 第4节 分子间作用力与物质性质 学案
- 42018-2019学年鲁科版选修三 第2章 第4节分子间作用力与物质性质 学案
- 52019-2020学年苏教版选修三 专题3 第4单元 分子间作用力 分子晶体 学案
- 62019-2020学年苏教版选修3 专题3第四单元 分子间作用力 分子晶体 学案
- 72019-2020学年苏教版选修3 专题三 第四单元 分子间作用力 分子晶体 学案
- 82019-2020学年苏教版选修3 专题3第四单元 分子间作用力 分子晶体(第2课时) 学案
- 92019-2020学年苏教版选修3 专题3第四单元 分子间作用力 分子晶体(第1课时) 学案