课时2 预测同主族元素的性质
目标与素养:1.以ⅠA族、ⅦA族元素为例,掌握同主族元素性质的递变规律。(证据推理)2.能运用原子结构理论初步解释同主族元素性质的递变规律。(微观探析)3.掌握由同主族元素的性质特点预测不熟悉元素的性质。(模型认知)4.了解元素周期表的应用。(社会责任)
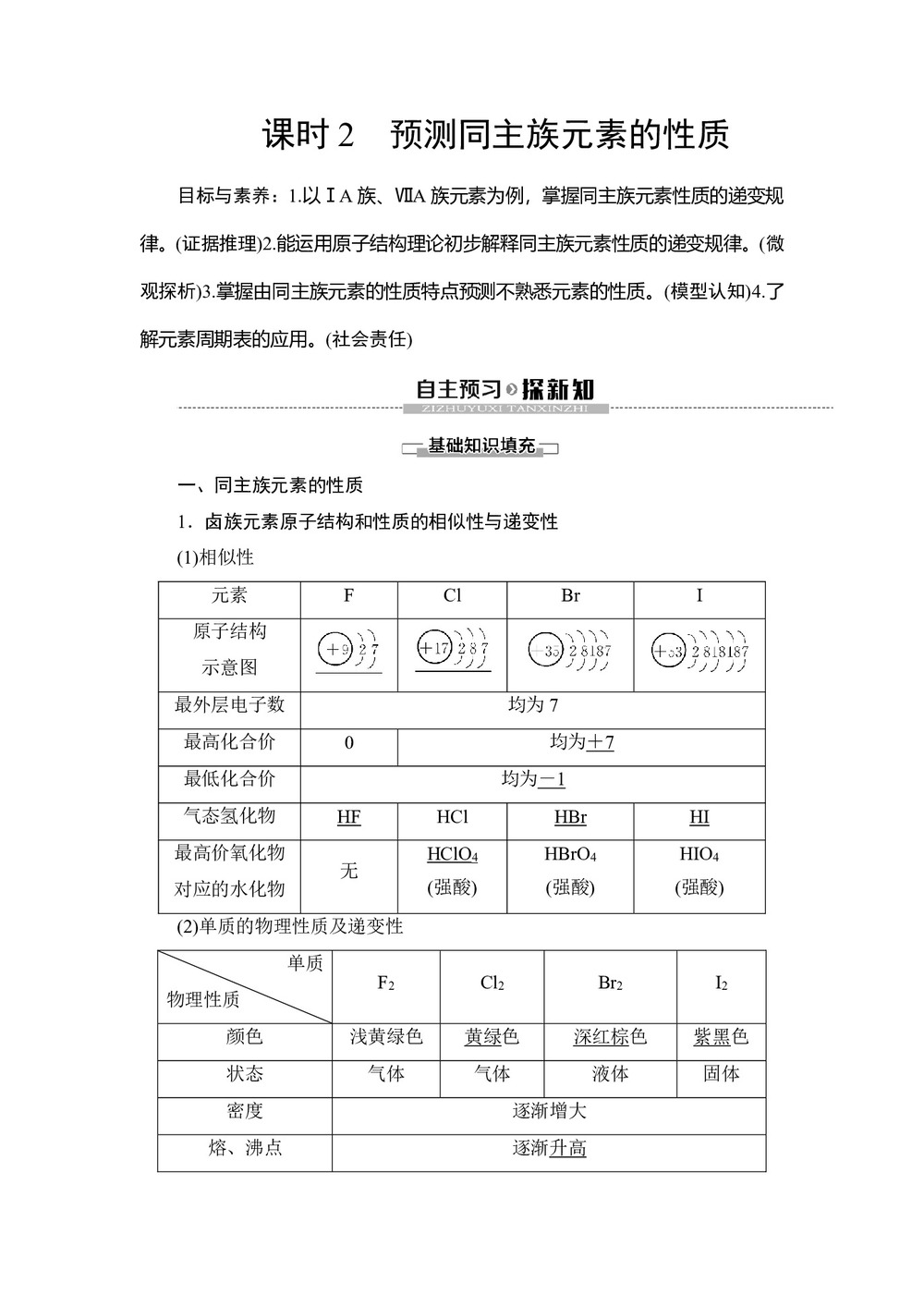
一、同主族元素的性质
1.卤族元素原子结构和性质的相似性与递变性
(1)相似性
元素 F Cl Br I 原子结构
示意图 最外层电子数 均为7 最高化合价 0 均为+7 最低化合价 均为-1 气态氢化物 HF HCl HBr HI 最高价氧化物
对应的水化物 无 HClO4
(强酸) HBrO4
(强酸) HIO4
(强酸) (2)单质的物理性质及递变性
单质
物理性质 F2 Cl2 Br2 I2 颜色 浅黄绿色 黄绿色 深红棕色 紫黑色 状态 气体 气体 液体 固体 密度 逐渐增大 熔、沸点 逐渐升高
-
相关课件下载
- 12019-2020学年鲁科版必修二 第1章 第3节 课时2 预测同主族元素的性质 课件(43张)
- 22017-2018学年鲁科版必修2 第1章 第3节 第2课时 预测同主族元素的性质 课件(30张)
- 32018-2019学年化学同步鲁科版必修2课件:第1章 第3节 第2课时 预测同主族元素的性质
- 42019-2020学年鲁科版必修2 第一章 第三节 第2课时 预测同主族元素的性质 课件(42张)
- 52019-2020学年鲁科版必修2 第1章第3节第2课时 认识同主族元素性质的递变规律 课件(51张)
- 61.3.2预测同主族元素的性质 课件(鲁科版必修2)
- 72019-2020学年鲁科版必修2第1章 第3节第1课时认识同周期元素性质的递变规律学案
- 82019-2020学年鲁科版必修2 第1章第3节第1课时 认识同周期元素性质的递变规律 课件(43张)
- 92018-2019学年化学同步鲁科版必修2课件:第1章 第3节 第1课时 认识同周期元素性质的递变规律