【高考直通车】
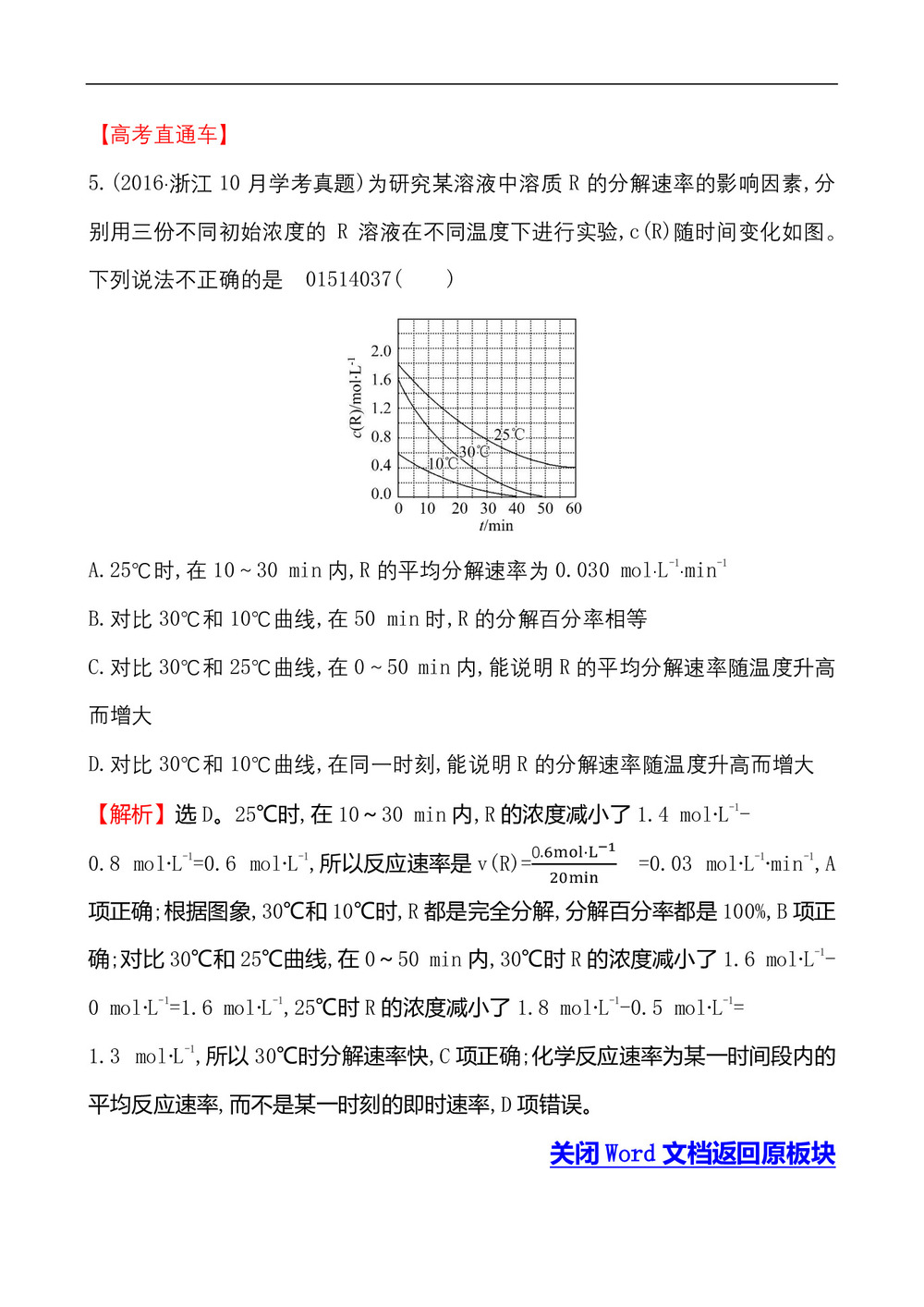
5.(2016·浙江10月学考真题)为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是 01514037( )
A.25℃时,在10~30 min内,R的平均分解速率为0.030 mol·L-1·min-1
B.对比30℃和10℃曲线,在50 min时,R的分解百分率相等
C.对比30℃和25℃曲线,在0~50 min内,能说明R的平均分解速率随温度升高而增大
D.对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
【解析】选D。25℃时,在10~30 min内,R的浓度减小了1.4 mol·L-1-
0.8 mol·L-1=0.6 mol·L-1,所以反应速率是v(R)=(0.6mol·L^(-1))/20min =0.03 mol·L-1·min-1,A项正确;根据图象,30℃和10℃时,R都是完全分解,分解百分率都是100%,B项正确;对比30℃和25℃曲线,在0~50 min内,30℃时R的浓度减小了1.6 mol·L-1-
0 mol·L-1=1.6 mol·L-1,25℃时R的浓度减小了1.8 mol·L-1-0.5 mol·L-1=
1.3 mol·L-1,所以30℃时分解速率快,C项正确;化学反应速率为某一时间段内的平均反应速率,而不是某一时刻的即时速率,D项错误。
关闭Word文档返回原板块
-
相关试卷下载
- 12019-2020学年鲁科版必修2第2章第2节 化学反应的快慢和限度第1课件作业
- 22019-2020学年鲁科版必修2第2章第2节 化学反应的快慢和限度第2课件作业1
- 32019-2020学年鲁科版必修2 第2章第2节 化学反应的快慢和限度(第2课时) 作业(1)
- 42019-2020学年鲁科版必修2 第2章第2节 化学反应的快慢和限度(第1课时) 作业
- 52019-2020学年鲁科版必修2第2章第2节 化学反应的快慢和限度作业
- 62019-2020学年鲁科版必修2第2章第2节化学反应的快慢和限度第2课时作业
- 72018-2019学年鲁科版必修2第2章 第2节化学反应的快慢和限度第1课时作业
- 82018-2019学年鲁科版必修2第2章第2节化学反应的快慢和限度第1课时作业
- 92018-2019学年鲁科版必修2 第2章第2节 化学反应的快慢和限度 作业