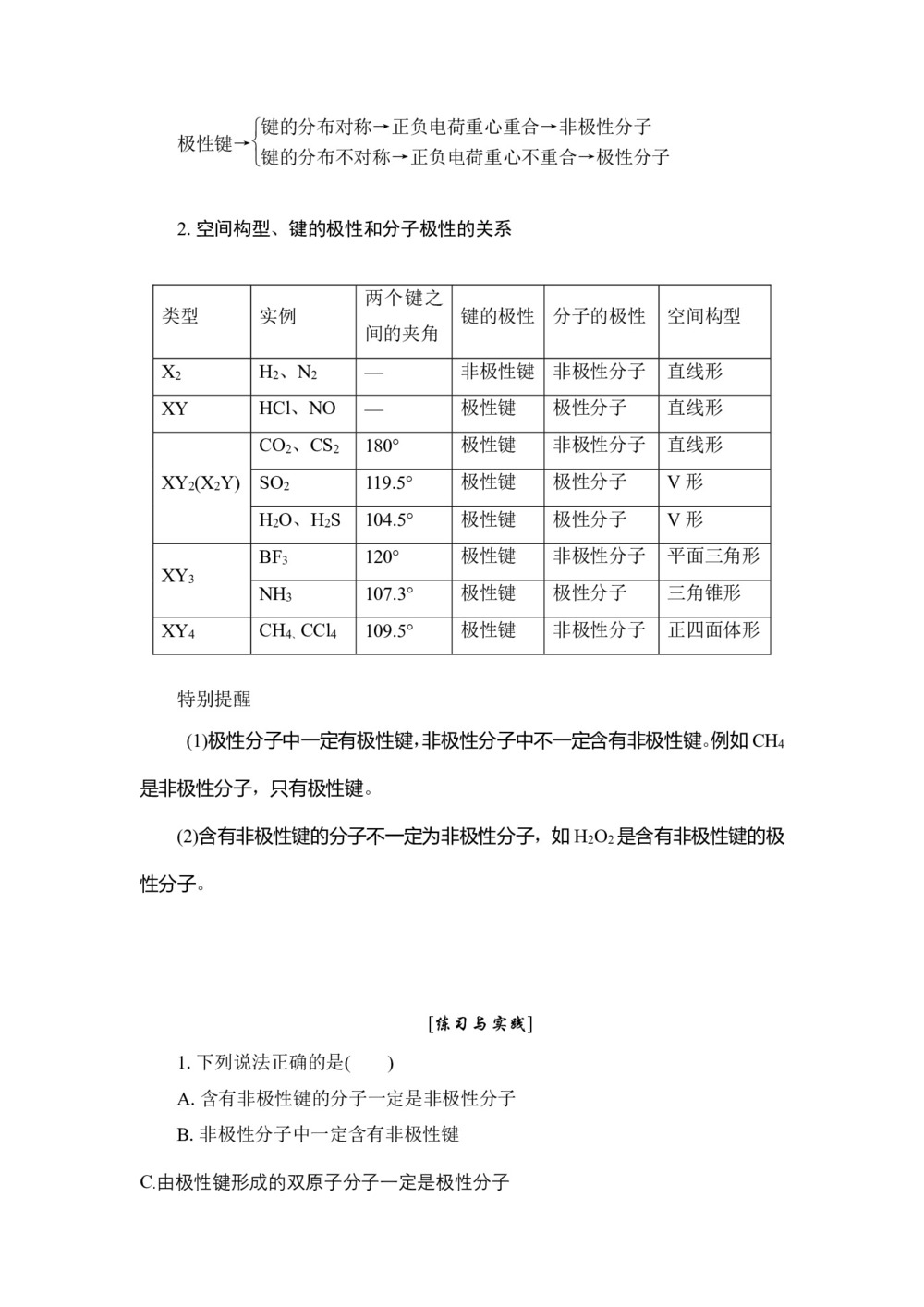
极性键→
2.空间构型、键的极性和分子极性的关系
类型 实例 两个键之间的夹角 键的极性 分子的极性 空间构型 X2 H2、N2 - 非极性键 非极性分子 直线形 XY HCl、NO - 极性键 极性分子 直线形 XY2(X2Y) CO2、CS2 180° 极性键 非极性分子 直线形 SO2 119.5° 极性键 极性分子 V形 H2O、H2S 104.5° 极性键 极性分子 V形 XY3 BF3 120° 极性键 非极性分子 平面三角形 NH3 107.3° 极性键 极性分子 三角锥形 XY4 CH4、CCl4 109.5° 极性键 非极性分子 正四面体形
特别提醒
(1)极性分子中一定有极性键,非极性分子中不一定含有非极性键。例如CH4是非极性分子,只有极性键。
(2)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
[练习与实践]
1.下列说法正确的是( )
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.由极性键形成的双原子分子一定是极性分子
-
相关教案下载
- 12018-2019学年苏教版选修3 专题4 第一单元 第3课时 分子的极性 手性分子 学案
- 22019-2020学年苏教版选修三 专题4 第1单元 第2课时 分子的极性与手性分子 学案
- 3人教版 《 选修三 第二章 分子结构与性质 第三节 分子的性质 非极性分子和极性分子》1课时
- 42019-2020学年苏教版选修3 专题3第四单元 分子间作用力 分子晶体(第2课时) 学案
- 52019-2020学年苏教版选修3 专题3第四单元 分子间作用力 分子晶体(第1课时) 学案
- 62019-2020学年苏教版选修3 专题四 第一单元 第一课时 杂化轨道理论与分子空间构型 学案
- 72019-2020学年苏教版选修3 专题三 第四单元 分子间作用力 分子晶体 学案
- 82019-2020学年苏教版选修三 专题4 第1单元 第1课时 分子的空间构型 学案
- 92019-2020学年苏教版选修3 专题4第一单元 分子构型与物质的性质 学案